ガイドライン・臨床試験・開発の背景・Q&A

ガイドライン

2016年のMINDACT試験の結果報告を受けて、MammaPrintを掲載する医学会のガイドラインが増え、推奨の範囲も広げられました。今日ではMammaPrintは、ザンクトガレン国際乳癌学会、米国臨床腫瘍学会(ASCO)、欧州臨床腫瘍学会(ESMO)、全米総合がん情報ネットワーク(NCCN)、などの主要な国際学会のガイドラインや、日本国内の乳癌診療ガイドラインで掲載あるいは推奨されています。
現在では、再発リスクの評価や術前療法の判断において、免疫組織化学染色(IHC)といった従来の検査に加えて多遺伝子アッセイによる検査を考慮することで、最適な治療が実現できる可能性があると認識されています。
臨床試験

Agendiaでは、20年以上にわたって臨床での検証を実施してきました。200以上の医療機関と共同研究を行い、発表した論文の数は100を超えます。
現在進行中の臨床試験
- FLEX
- I-SPY2
- PRECiSE
現在進行中の臨床試験について、詳しくはAgendia社サイト(英語)をご参照ください。
https://agendia.com/ongoing-trials/
実施済み臨床試験
MINDACT 試験
(Microarray In Node-negative and 1-3 node-positive Disease may Avoid ChemoTherapy)sponsored by the European Organization for Research and Treatment of Cancer (EORTC-10041/BIG3-04)
臨床的ハイリスクでも化学療法を回避可能な患者を同定可能
目的
早期乳がん患者を対象に、術後補助化学療法の実施判断をするために、標準的な臨床病理学的リスク判定にMammaPrintを加えることの有用性を検証した前向きランダム化臨床試験(第III相試験)です。2007年から2011年にかけて、9カ国112施設で、早期乳がんの手術を受けた女性6,693人がこの試験に登録され、臨床的高リスク(クリニカルハイリスク)の早期乳がん患者がMammaPrintローリスクのときに化学療法の回避が可能かどうかの検証が行われました。
結果
2016年に、New England Journal of Medicine で最初の結果が報告され、5年後無遠隔転移生存率を指標として臨床的高リスクかつMammaPrintローリスクの場合は化学療法を回避できることが示されました。さらに追跡期間中央値約9年のデータについてASCO2020、SABCS2020で学会発表され約9年後においても同様の結果が得られることが示されました。この結果は、2021年にはLANCET Oncologyで報告されました。
-
46%
-
臨床的高リスクに該当する術後化学療法の対象となる患者の46%は、治療成績に影響を与えずに、化学療法の回避が可能でした。1
-
リンパ節転移陽性(最大3個)かつ臨床的高リスクである患者においても、MammaPrint ローリスクと判定された患者は、化学療法を受けなくても95%は5年後の遠隔転移が認められませんでした。2
-
95%
-
90%
-
臨床的高リスクの50歳以上の患者のうち、MammaPrint ローリスクと判定された患者は化学療法等の積極的治療を回避できます。このサブグループの患者は、化学療法の有無にかかわらず、8年後の 無遠隔転移生存期間(DMFS)率は90%でした。2
The New England Journal of Medicine掲載論文はこちら
https://www.nejm.org/doi/pdf/10.1056/NEJMoa1602253
THE LANCET Oncology掲載論文はこちら
https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(21)00007-3/fulltext
STO-3 試験
(Stockholm Tamoxifen Trial )
内分泌療法の投与期間短縮を可能にするUltra Low Lisk
目的
Stockholm Tamoxifen Trial(STO-3)は、閉経後の女性に対する術後補助療法としてのタモキシフェンの有効性の評価を目的に行われました。JAMA Oncology誌に掲載されたEssermanらの論文では、この試験で20年後の追跡データがある患者サンプルをMammaPrintで解析し、内分泌療法実施期間を短縮できる極めて悪性度の低い乳がん(Ultra Low Risk)を特定するために使用できるかどうかを検証しました。
結果
MammaPrintにより、診断から20年後のがん再発リスクが極めて低いUltra Low Risk患者のサブグループを正確に特定できることが示されました。このサブグループでは、内分泌療法を受けなかった患者と、内分泌療法を受けた患者との間のがん20年生存率に、統計的に有意な差はありませんでした。なお、内分泌療法投与群は、65%の患者がタモキシフェン2年投与、35%は5年投与がされていました。
-
97%
-
MammaPrintでUltra Low Risk(ウルトラローリスク)と判定された患者が、2年または5年のタモキシフェン治療を受けた場合、がん20年生存率は97%でした。3
-
それに対して、MammaPrintでUltra Low Riskと判定された患者が、タモキシフェン治療を受けなかった場合のがん20年生存率は94%でした。3
-
94%
JAMA Oncology掲載論文はこちら
https://jamanetwork.com/journals/jamaoncology/article-abstract/2634502
NBRST試験
(Neoadjuvant Breast Registry Symphony Trial)
術前治療計画
分子サブタイプによる治療成績の向上
目的
術前治療におけるMammaPrintおよびBluePrintの検査としての有用性を実証することを目的とした試験です。
結果
本試験により、術前治療に対するMammaPrint と BluePrint の幅広い有効性が示されました。まず、MammaPrint と BluePrint は、術前療法に対する病理学的完全奏効(pCR)の可能性を正確に予測しました。さらに、BluePrint は患者を臨床サブタイプとは異なる分子サブタイプに再分類しました。5年にわたる前向き試験において、MammaPrintとBluePrintが患者を異なる分子サブタイプに分類することで、治療成績を上げることが示されました。
-
22%
-
BluePrintにより、症例の22%で腫瘍は従来の臨床サブタイプとは異なる分子サブタイプに再分類されました。4
-
病理学的に ER陽性であっても、BluePrint で Basal 型の判定が出た患者では、術前化学療法に対して34%のpCR率を示しました(Blue Print Luminal 型では、6%以下)4
-
34%
-
94%
-
Luminal A 型の患者では、術前内分泌療法のみを行った場合でも5年後のDMFSは94%でした。4
Breast Oncology掲載論文はこちら
https://link.springer.com/article/10.1245/s10434-014-3908-y
IMPACt 試験
(Impact of MammaPrint on Adjuvant and Neoadjuvant Treatment in Breast Cancer Patient)
MammaPrint と BluePrint の臨床における治療計画への影響
目的
IMPACt試験は、MammaPrint と BluePrint の結果がどのように医師に利用されているか、および、この検査が医師の治療計画に対する信頼を高めるのか、あるいは低下させるのかを評価するために実施されました。
結果
調査結果により、MammaPrint と BluePrint の結果が治療計画で考慮され、患者への説明に用いられていることが示されました。
従来の臨床病理学的リスク判定の結果とMammaPrint、BluePrintの結果が不一致の場合では、医師と患者はMammaPrint、BluePrintの結果にそって治療計画を立案するほうが多いことが示されました。
ほとんどの症例でMammaPrint と BluePrint の結果を用いることで医師の治療計画に対する信頼を高めることが示されました。
-
40%
-
40%の症例で、BluePrint は腫瘍を病理学的サブタイプから異なる分子サブタイプへ再分類しました。5
-
臨床的高リスク、MammaPrint ローリスクの患者に対する化学療法の使用が60%減少しました。
-
60%
-
80%
-
80%の症例で、MammaPrint と BluePrintを使用することにより、医師および患者は治療計画に対する信頼が高まりました。
BMC Cancer掲載論文はこちら
https://bmccancer.biomedcentral.com/articles/10.1186/s12885-020-6534-z
参考文献
1)Cardoso, F., et al. N Engl J Med 2016;375:717-29.
2)Cardoso, et al. J Clin Oncol 38, no. 15_suppl (May 20, 2020) 506-506.
3)Esserman, et al. JAMA Oncol. 2017 Nov
4)Whitworth P., et al. 2020 San Antonio Breast Cancer Symposium; 2020 Dec 8-11; San Antonio, TX. AACR; Abstract PD9-01.
5)Soliman, et al. BMC Cancer (2020) 20:81.
開発の背景

MammaPrint(マンマプリント)は、乳癌を2群に分類する予後予測検査です。
マンマプリントは、2007年、米国医薬品食品局(FDA)より、IVDMIA(体外診断薬多変量測定)分野で世界初の承認を得ました。
マンマプリントは、70遺伝子シグニチャー(遺伝子の発現状態)を用いて、早期乳癌の術後再発リスクを評価し、術後の化学療法によるベネフィットの有無を判断可能にします。遺伝子の発現状態を指標化した新しい技術を用いており、乳癌の性質を遺伝子(RNA)レベルで観察します。
マンマプリントでは、転移カスケードに関連する遺伝子の発現状態を調べています。これらは70遺伝子から構成されており、乳癌を低リスクあるいは高リスクの2群のいずれかに分類します。マンマプリントには中間リスクはありません。
マンマプリント分類と従来型病理分類で、双方が低リスクならば、内分泌療法を、また双方で違いが見られる場合でも、マンマプリントでの低リスクを考慮し、化学療法の回避が可能です。
マンマプリントを用いることで、個々の患者の腫瘍の性質についてより詳しい情報が得られ、個人別の治療プロトコールを組み立てることができます。
遺伝子発現解析
バイアスのない遺伝子選択アプローチ遺伝子発現解析
当初は70遺伝子アムステルダム・シグニチャーと呼ばれていたマンマプリントは、最適化された成果を得るために最高の技術、理想的な組織検体、全ゲノムアプローチを用いた研究努力の中で開発されました。その目的は早期乳癌患者の再発リスクを同定すること、ひいては個別化医療を可能にすることにありました。
遺伝子プロファイル検査の開発
2002年ネイチャー誌に発表されたように、手術の時点では治療歴がなく、手術の後に10年間の予後データの残されている乳癌患者サンプルを元に開発されました。従って、術後療法の治療内容に影響されることなく、研究結果の有効性を確保することができました。また、エストロゲン受容体の陽性・陰性双方のサンプルが含まれていました。マンマプリント遺伝子はバイアスのないゲノムワイドアプローチを用いて選択されました。つまり、他の多遺伝子アッセイとは開発のアプローチが異なり、論文で報告された予後に関連する遺伝子を選択したのではなく、一から網羅的なゲノム解析を行い遠隔転移に関連する遺伝子をリストアップする、バイアスのない遺伝子選択アプローチで開発されました。その結果、ヒトゲノム25000遺伝子から231個の乳癌予後に特有な遺伝子が選択されました。2次元クラスター解析を用い、Leave-one-out Cross Validationを行い、遠隔転移と最も相関のあるとされる70遺伝子が示され、マンマプリント70遺伝子プロファイルが同定されました。これらの70遺伝子は、当初はMTDH遺伝子のようにどのような働きをしているか判明していない遺伝子も多かったのですが、その後の研究により今日では再発における重要なプロセス、すなわち細胞周期、血管新生、浸潤、細胞移動、シグナル伝達などに関連していることがわかっています。(参考文献2)
マンマプリントプロファイルは、腫瘍の再発リスクをハイリスクあるいはローリスクのいずれかに分類します。ほかの臨床で用いられている指標と共に考慮することにより、どの患者がより補助療法の恩恵を受けるのかを同定するツールとなります。従来のリスク分類と比較して、マンマプリントはこれまでなら予後不良で化学療法適応と評価されていた患者の数を有意に減らすことができます。また、ローリスクでもホルモン療法の投与期間の決定をサポートします。病理診断で得られなかった結果が得られることもあります。それは、マンマプリントが腫瘍自体の遺伝子の活性度を分析するために遺伝子発現解析を利用しているためです。情報が増えることで、より多くの患者のQOLを改善する手助けができるでしょう。(参考文献3)
参考文献
2)van `t Veer LJ Dai H, van de Vijver MJ,et. al., Nature 2002; 415(31): 530-536
3) Buyse M, Loi S, Van’t Veer L, et. al., J Natl Cancer Inst 2006; 98(17):1183-1192
研究成果
マンマプリントを使用した臨床研究例など最新の情報はAgendia社サイトをご参照ください。 http://www.agendia.com/category/mammaprint/
MammaPrint 搭載遺伝子とがん転移の初期プロセスの関係
MammaPrintで抽出された遺伝子は、がん転移の初期の転移浸潤の7つのステップすべての過程に関連していることがわかっています。
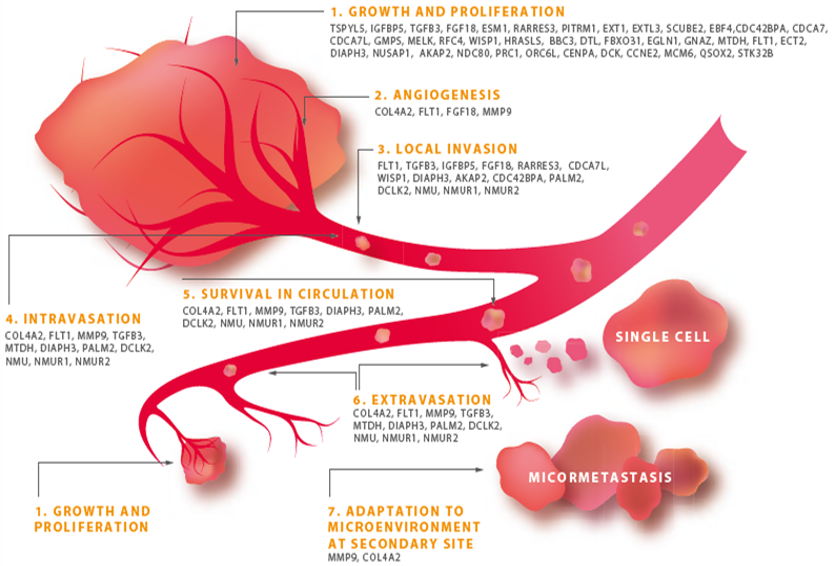
- AND PROLIFERATION 増殖
- ANGIOGENESIS 血管新生
- LOCAL INVASION 局所浸潤
- INTRAVASATION 脈管浸潤
- SURVIVAL IN CIRCULATION 血液循環での生存
- EXTRA VASATION 血管外漏出
- ADAPTATION TO MICROENVIRONMENT AT SECONDARY SITE 転移部位での微小環境適応
バイアスのない遺伝子選択アプローチ遺伝子発現解析
70遺伝子シグニチャー
バイアスのない遺伝子選択プロセスがもたらしたもの
マンマプリントは、転移プロセスに関する全遺伝子をカバーし、遺伝子発現プロファイルのわずかな個人差を検出することにより、患者を二つのグループ(ハイリスクとローリスク)に分類することができます。
2009年1月のNature Cell誌に発表されたように、ニュージャージー州癌研究所とプリンストン大学の研究チームによって発見された遺伝子、MTDHあるいはmetadherin(メタドヘリン)は、ハイリスク乳癌の40%前後に予後不良因子として関わっているらしいことが分かりました。MTDH遺伝子は転移や化学療法への耐性に関連しているとみられています。MTDHは重要な遺伝子ですが、ごく最近になるまでMTDH遺伝子の働きについては知られていませんでした。2002年にマンマプリントが初めて報告された時点ではMTDH遺伝子の役割自体は不明でした。
MTDH遺伝子はマンマプリント・シグニチャーに含まれている遺伝子です。マンマプリントが開発されたとき、MTDH遺伝子の役割自体は解明されていませんでしたが、バイアスのない遺伝子選択プロセスで有意性のあることは自明でした。そのためMTDH遺伝子は当初より70遺伝子プロファイルに含まれていました。
興味深いことに、もしもマンマプリント開発者が当時論文発表されていた候補遺伝子セットのみを考慮していたら、間違いなくMTDH遺伝子は重要ではないものとして看過されていたでしょう。マンマプリントにはサイエンスの価値が息づいています。転移の全パスウェイを包括的に分析することによってのみ、患者の真の再発リスクが理解されるのです。
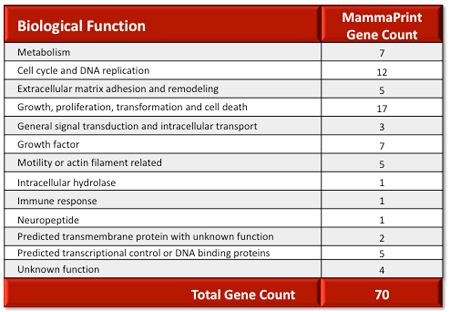
表.MammaPrint Genes by Biological Function in the Metastatic Cascade
転移カスケードにおける生物学的機能別マンマプリント遺伝子
研究開発経緯
検査法開発における無治療検体使用の重要性
無治療の検体を用いた検査法開発にはどのようなベネフィットがあるでしょうか?
例えば術後に内分泌療法の投与を受けている検体を用いて検査法の開発を行った場合、その検査法による結果の解釈は、内分泌療法の有効性の影響がある前提ということになります。
しかし、実臨床では内分泌療法を完遂できないも症例あり、患者の受ける治療のアドヒアランスにより検査法の開発の前提とは異なる状況が臨床で発生します。
例えば、治療完遂を前提として開発された検査法により低リスクと判定された患者が内分泌療法(5年間のタモキシフェンまたはアロマターゼ阻害剤など)を選択した場合に、万一患者が計画治療を完遂できない場合には低リスクという判定の前提とは異なってしまいます。そうなると、実際は高リスクの患者なのかもしれないとの疑念が残ってしまいます。
こういった状況を避けるためにも、無治療の患者コホートを用いてバイアスのない検査方法の開発と検証を行うことの重要性が着目されています。
また、無治療の検体を使用した検査法開発では、内分泌療法などの治療の影響を受けた後と比べて腫瘍生物学的情報をより多く得ることができます。こうして生まれた検査法は、治療による影響のない腫瘍生物学に基づくものであるため、どのような治療をその後選択したかに関わりなく使用できる検査といえます。
それぞれ緑色と赤色で示されたローリスク、ハイリスク患者からなる図をご覧ください。(図1)
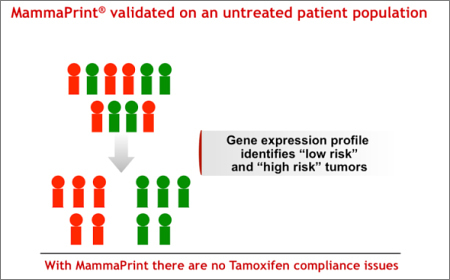
図1
MammaPrintでは、バイアスのない遺伝子プロファイルの使用により、治療選択や治療完遂の有無に関わらず、患者のリスクカテゴリー分類の適応を可能にします。
治療後の検体によって開発された検査法はバイアスのある治療計画を導きかねないことを前提にしなければなりません。(図2)
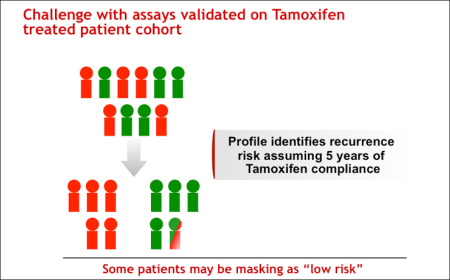
図2
マンマプリントは無治療検体で開発・検証されました
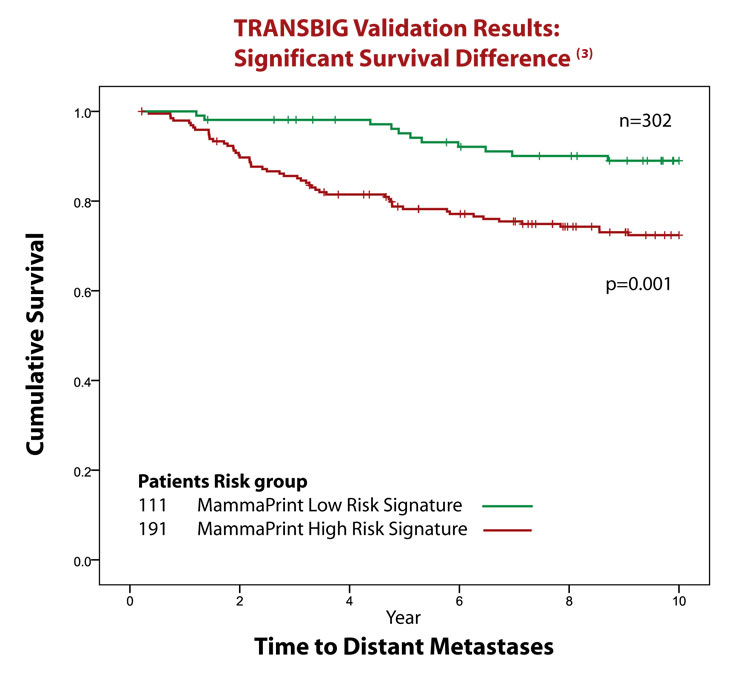
Nature誌に報告されたように、マンマプリントは10年間の予後情報付きの無治療検体によって開発されました。従って、その後に選択されたレジメンによる治療に関わらず、検査結果の有効性を確かなものにしています。臨床試験TRANSBIGにおいて、多施設による302症例(治療前)がJNCI誌に報告されていますが、その中でマンマプリントはリスク分類を正確に実施できることが実証されました。
Validation
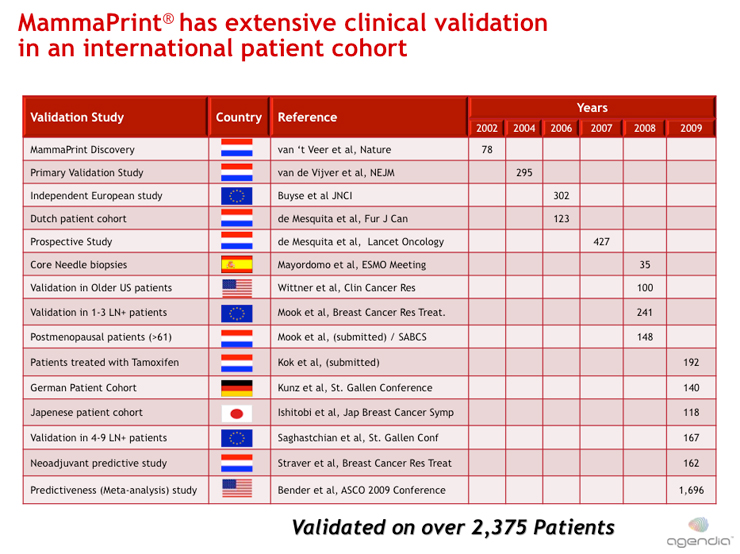
臨床試験による検証
マンマプリントは、いくつかの臨床試験により、計2,375症例以上の検体によってそれぞれ独立に検証されてきました(当時)。それぞれの臨床試験の結果はピアレビュー付きの医学系、科学系の論文誌に発表されています。
最初の検証は295症例でNEJM誌に報告されました。ローリスク群の患者の10年後無転移生存期間率は87%、ハイリスク群では44%でした。COX比例ハザードモデルにより、遺伝子プロファイルはそれ自体が統計的に独立した予後因子であり、ハザード比HR = 4.6 (95%信頼区間 2.3 - 9.2) でした。(参考文献4)
さらに別の検証はTRANSBIG コンソーシアムによる10年間の観察期間付きの302症例(補助療法なし)でJNCI誌に報告されました。ローリスク群の患者の10年後無転移は90%、ハイリスク群では71%でした。マンマプリントはリンパ節転移無し(LN0)患者群において、患者年齢、腫瘍グレード、腫瘍サイズ、ERステータスによる分類を超えた予後予測情報を提供できることが示されました。これらの患者は補助化学療法を受けていませんでした。(参考文献3)
さらにLancet Oncology誌(参考文献8)、Breast Cancer Treatment and Research誌(参考文献9)、Clinical Cancer Research誌(参考文献10)でもそれぞれマンマプリントが検証された結果が報告されています。また、マサチューセッツ総合病院での試験では年齢層が高いアメリカ人患者でのマンマプリント有効性が報告され(参考文献10)、リンパ節転移が1個から3個までの患者においても、マンマプリントが有効である試験結果が報告されました。(参考文献11)
今日までに14,000症例以上の解析実績があり、技術的ロバスト性、信頼性が確立されました。マンマプリントは癌治療のための個人化医療の意義ある一歩を進めるものとなりました。医師のために癌の情報量を増やし、個人化治療決定の支援をします。
参考文献
3)Buyse M, Loi S, Van’t Veer L, et. al., J Natl Cancer Inst 2006; 98(17):1183-1192
4)van de Vijver MJ, He YD, van’t Veer LJ, et. al.,New Engl J Med 2002; 347(25):1999-2009
8)Bueno-de-Mesquita J, van Harten WH, Petel VP, et. al., Lancet Oncology 2007; 8(12): 1079-87
9)Bueno-de-Mesquita JM, Linn SC, Keijzer R, et. al., Breast Cancer Research 2008; Sept 26
10)Wittner BS, Sgroi, DC, Ryan PD, et. al., Clinical Cancer Research 2008; 14(10): 2988-2993
11)Mook S, Schmidt MK,Viale G, et. al., Breast Cancer Res Treat, 2008; July 27
Prognosis & Prediction
個別化医療に前進
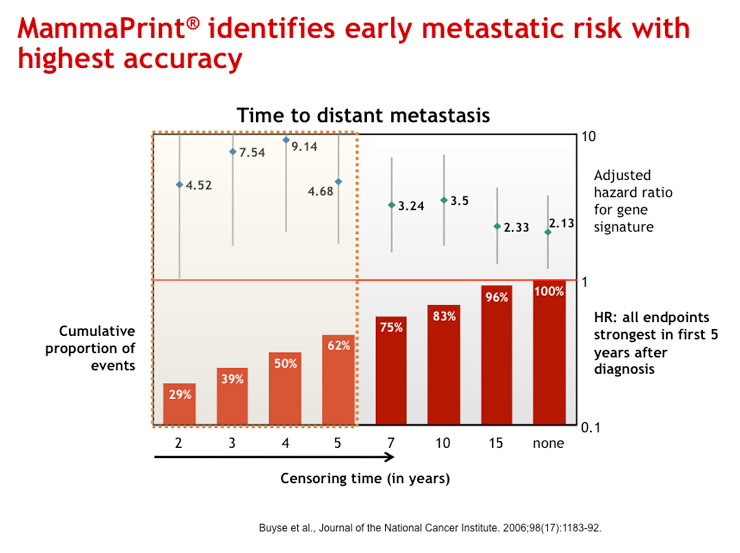
医師は早期発見が治療の成功へのキーだと認識しています。乳癌が早期に発見されれば腫瘍は外科的に切除され、適切な治療により多くの患者は完全に回復します。にもかかわらず5年から10年のうちに早期発見だった患者の30%前後に乳癌の再発がみられます。全身補助療法の有効性を評価するためには転移リスクの高い患者を正確に同定することが必須です。
およそ3分の1の患者にとって化学療法や内分泌療法(タモキシフェンやアロマターゼ阻害剤)などの補助療法によりリスクが軽減する一方で、70%以上の患者にとって、補助療法がなくても生存でき有害な副作用を避けることができるかもしれないとする予測があります。(参考文献1)つまり、不必要な治療による身体的、経済的負担を回避できる可能性の把握が可能になります。
初期の転移リスクを同定
マンマプリントの特質は診断から5年以内の初期の転移の傾向を同定する能力にあります。(参考文献3)Early Breast Cancer Trialists' Collaborative Groupによる報告にあるように、補助化学療法は最初の5年間の初期の転移を軽減するのに威力を発揮します。(参考文献1)この2つの期間の一致は、マンマプリントが補助化学療法のメリットの評価において、最大限に有用性を発揮するツールであることを示しています。
参考文献
1)EBCTCG, Lancet Oncology 2005; 365: 1687 -1717
3)Buyse M, Loi S, Van’t Veer L, et. al., J Natl Cancer Inst 2006; 98(17):1183-1192
Q&A

検体は診断時のCNB、手術時に摘出の組織ともに使用可能です。
MammaPrint ローリスクの結果は、患者の癌が再発しないことを保証するものではありませんが、MammaPrint の結果をほかの臨床因子と併せて考慮することは、個々の乳がんにあった治療方針の決定に役立ちます。
詳しくは、このウェブサイトのMammaPrint のページをご覧ください。
文献1:Cardoso F. N Engl J Med 2016; 375: 715-729
詳しくは、このウェブサイトの,MammaPrintおよびBluePrintのページをご覧ください。
文献1:Cardoso F. N Engl J Med 2016; 375: 715-729
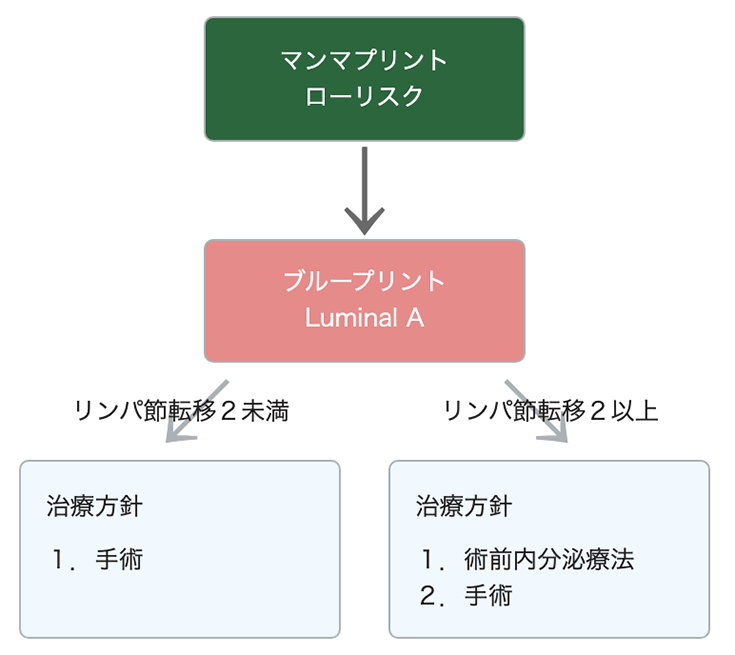
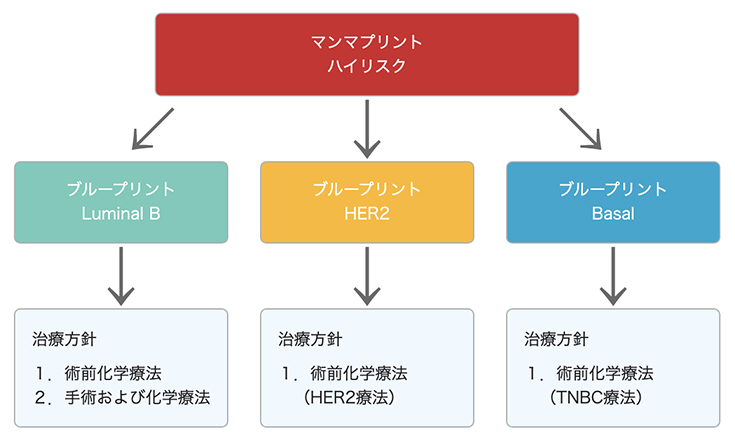
MammaPrint と BluePrint を組み合わせることで、Luminal 型(AまたはB)、Basal 型、あるいは HER2 型かを決定します。これらの結果は、どの治療が最も適切であるか腫瘍の特定の分子サブタイプに基づいた決定をするために重要です。
詳しくは、このウェブサイトのBluePrintのページをご覧ください。
MammaPrint と BluePrint を行った場合の治療例:ローリスクの場合
MammaPrint と BluePrint を行った場合の治療例:ハイリスクの場合
MINDACT試験により、臨床病理学的に再発リスクが高いと判断され、通常は術後化学療法の候補となる患者の46%がMammaPrint により低リスクに再分類され、不必要な化学療法を回避できる可能性があることが示されました1。
MINDACT 試験について詳しくは、このウェブサイトのMammaPrintのページをご覧ください
文献1:Cardoso F. N Engl J Med 2016; 375: 715-729
追加の費用がかかるため、患者の負担については別途考慮が必要です。
https://agendia.com/our-tests/
Contact
お問い合わせ
検査に関するご依頼、お問い合わせは下記より担当窓口へお問い合わせください。

